ISO 14971 : maitriser la gestion des risques
Anticiper et sécuriser l'accès au marché de son dispositif médical
Date de publication
01/02/2024
Anticiper et sécuriser l'accès au marché de son dispositif médical
Date de publication
01/02/2024

L'objectif premier du marquage CE, et plus généralement des normes / règlements, est d'assurer la sécurité des dispositifs médicaux et, par extension, de protéger les usagers.
Pour atteindre cet objectif, l'une des principales préoccupations réside dans la gestion proactive des risques associés aux dispositifs médicaux (ceci pour toutes classes de risque confondues DM ou DM-DIV).
Pour initier la gestion des risques, les fabricants peuvent s’appuyer sur la norme ISO 14971. C’est une norme harmonisée aux exigences réglementaires sur les dispositifs médicaux (hardware, software et DM-DIV), qui décrit un processus permettant de gérer les risques associés à un dispositif médical tout au long de son cycle de vie.
Figure 1 : concept de la gestion des risques selon l’ISO 14971
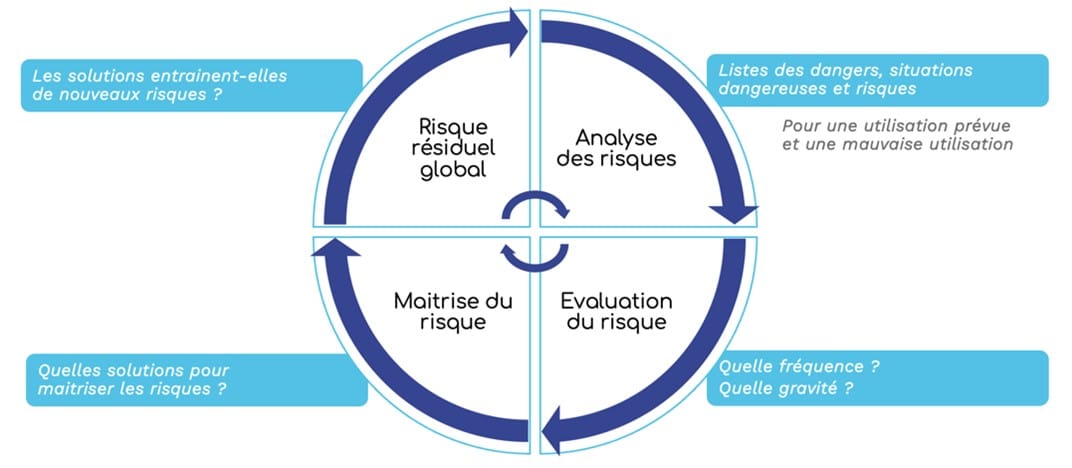
Qu’est-ce que le risque ?
Un risque représente un dommage qui "pourrait" survenir.
Il est un indicateur de survenue d’un événement et se caractérise selon deux paramètres :
Pour définir les niveaux de risque, il faut tout d’abord identifier les grades pour chaque paramètres (occurrence / fréquence et gravité) et réaliser une matrice de risque qui permettra de faire la multiplication des 2 paramètres pour aboutir à un score. Dans l’exemple ci-dessous, il s'agit d'une matrice 3x3 (c'est-à-dire qu'il y a 3 grades choisi pour la gravité et 3 grades choisi pour la probabilité) mais il est possible de réaliser des matrices 4x4, 5x5, 10x10, etc. en fonction du dispositif, de sa classe et de son niveau de risque lié à l'utilisation. Plus les grades seront nombreux, plus la matrice sera fine.
Figure 2 : tableau d’exemple d’évaluation de risque

Quelle place dans la vie du DM ?
Le risque se retrouve à trois niveaux distincts dans le parcours d’un DM et ce durant tout son cycle de vie (de la fabrication / assemblage, au transport et à l’installation dans son environnement d’usage prévu, à l’utilisation, à la maintenance et également à la fin de vie).
Figure 3 : les 3 niveaux de risques liés à un DM
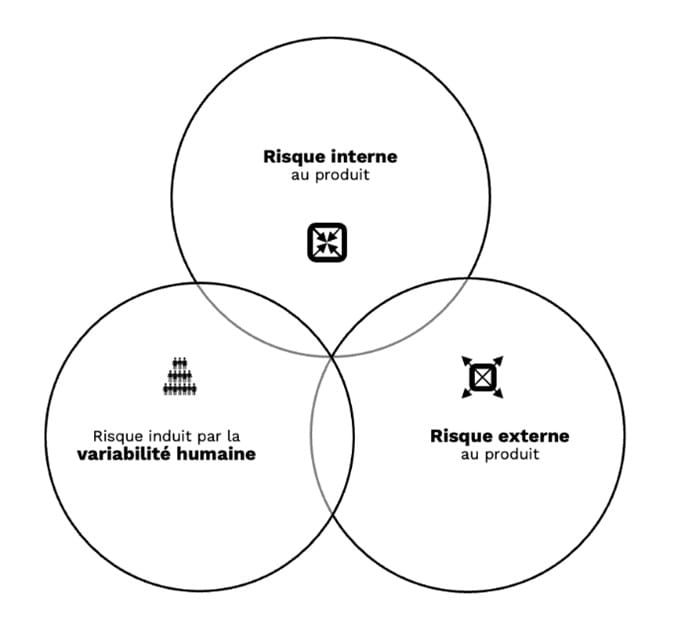
Pour chaque niveau, il est possible d’identifier un type de risque :
Dans le cadre de la règlementation (MDR 2017/745 Annexe I), la documentation technique se doit d’inclure une gestion des risques.
L’obtention du marquage CE est conditionné par la mise en place et la validation d’un triptyque d’éléments :
• la mise en place d’un Système de Management de la Qualité (SMQ conforme ISO 13485) au sein de l’entreprise à l’initiative du projet ;
• la rédaction de la Documentation Technique conforme à la réglementation européenne applicable pour gérer les risques autour du produit ;
• la sélection d’une voie d’évaluation clinique pour attester de la performance, de la sécurité et du bénéfice clinique du dispositif.
Note : dans la pratique le processus de gestion des risques fait souvent partie du Système de Management de la Qualité.
La gestion des risques est un processus itératif continu, concernant l’ensemble du cycle de vie d’un dispositif, qui doit périodiquement faire l’objet d’une mise à jour systématique.
La gestion et l’analyse des risques
La maitrise des risques doit être étudiée le plus tôt possible afin d’identifier tous les risques potentiels pouvant survenir lors de chaque étape du cycle de vie du produit.
Pour cela, le fabricant doit mettre en place un plan de gestion des risques pour identifier, évaluer, contrôler et surveiller les différents risques liés à son dispositif médical.
Pour effectuer l’analyse de ces risques, il est conseillé au fabricant de réaliser une matrice risque pour s’assurer de répondre aux exigences de performances et de sécurité.
C’est cette matrice qui devra ensuite être intégrée dans le dossier technique, élément indispensable pour pouvoir déposer son dossier d’évaluation de la conformité (marquage CE).
A noter qu’un risque ne peut pas être acceptable tant que son bénéfice n’est pas étudié et que son rapport bénéfice/risque est jugé positif. Il est conseillé de mettre en place une méthodologie en plusieurs étapes afin d’appuyer le fabricant dans sa démarche :
Bien planifier les utilisations prévues
Réaliser l’analyse des risques (identification et estimation) aux étapes suivantes dans le cycle de vie du produit :
Evaluation des risques (pour rappel : (risque) = (occurrence ou fréquence) x ( gravité))
Maitrise des risques :
Evaluation (acceptabilité) du risque résiduel puis résiduel global
Rapport/examen de la gestion des risques
Archivage de la gestion des risques (planification, résultats, conclusions et indicateurs pour le SAC.)
Note : L’AMDEC (“Analyse des Modes de Défaillances, de leurs Effets et de leur Criticité”) est l’un des outils présentés dans la norme comme une possible méthode applicable dans la gestion des risques afin d’analyser les risques. Cette méthode se base sur la probabilité, gravité, détectabilité).
La continuité dans le cycle de vie du DM
Il est primordial pour un fabricant de maitriser les risques liés à son produit avant sa mise sur le marché. Cette démarche doit pour autant s’inscrire dans une démarche continue. La gestion des risques se poursuit donc dans le cadre du suivi après-commercialisation.
Les retours d’expérience permettent ainsi la mise à jour et la réévaluation des risques.
La continuité de la gestion des risques se prolonge donc :
Suivez notre newsletter pensée pour et par les innovateurs en santé !
Au programme : nos actualités, analyses, invitations, rendez-vous de l'écosystème DM et MedTech...
Cet article est diffusé à titre informatif et ne constitue pas une référence normative ou règlementaire.