Fabricants de DM logiciels : ce que vous devez savoir
Définition et règlementation
Date de publication
14/03/2024
Définition et règlementation
Date de publication
14/03/2024
Contexte
Alors que les technologies de l’information continuent de faire progresser tous les aspects du soin, les logiciels sont devenus une partie importante des produits de santé, et leur contribution à l’amélioration de la santé des patients est incontestable. En parallèle, les exigences réglementaires et normatives se renforcent pour mieux contrôler ces dispositifs.
Pour les fabricants de dispositifs médicaux qui prévoient de démontrer la conformité de leur logiciel dans le cadre du règlement (UE) 2017/745 relatif aux dispositifs médicaux (RDM), la première étape est d'établir si leur logiciel répond à la définition d'un dispositif médical selon le RDM.

Qu’est-ce qu’un DM logiciel ?
Un dispositif médical logiciel, communément appelé « DM logiciel » est défini par le Forum International des Régulateurs de Dispositifs Médicaux (IMDRF) comme étant "un logiciel destiné à être utilisé à une ou plusieurs fins médicales et qui réalise ces fins sans faire partie d’un dispositif médical matériel ".
D’après le règlement (UE) 2017/745 relatif aux dispositifs médicaux (RDM), un DM logiciel fait référence à un logiciel conçu spécifiquement pour des applications médicales, agissant indépendamment d'un dispositif matériel. Il peut fonctionner seul (par exemple, une application de diagnostic) ou en association avec un dispositif médical (par exemple, un logiciel exploitant les données d’un capteur). Ces logiciels sont destinés à effectuer des tâches médicales telles que le diagnostic, le suivi, la prédiction ou l'interprétation des données, sans nécessiter de matériel médical spécifique pour fonctionner.
Les DM logiciels sont de plus en plus utilisés dans le soin, offrant des fonctionnalités avancées et des solutions personnalisées pour un large éventail de besoins médicaux. Ils peuvent être intégrés à des plateformes numériques diverses, facilitant ainsi leur déploiement dans les environnements cliniques et non cliniques. En tant que dispositifs médicaux à part entière, les DM logiciels sont soumis à des réglementations strictes visant à garantir leur sécurité, leur efficacité et leur conformité aux normes de qualité médicale.
Les fabricants de logiciels doivent alors examiner attentivement les exigences du règlement (UE) 2017/745 sur les dispositifs médicaux (RDM) pour déterminer si leur produit entre dans la définition d'un dispositif médical.
Note :
Un SiMD à l'inverse d'un SaMD est un logiciel intégré à un dispositif médical. Sans SiMD, le dispositif ne pourrait pas fonctionner, et inversement. Le SiMD n'est pas un dispositif médical à part entière mais est un élément d'un dispositif médical. Le cycle de vie du logiciel SiMD doit être conforme à la norme 62304, cependant, l'élément logiciel est aussi soumis aux exigences appliquées au dispositif médical dans lequel il est intégré.
Classification des logiciels dispositifs médicaux
Le guide MDCG 2019-11
Si votre logiciel répond à la définition d’un dispositif médical, le document d’orientation MDCG 2019-11 (Guidance on Qualification and Classification of Software in Regulation) définit sa qualification et sa classification selon le règlement (UE) 2017/745.
Il dresse un arbre de décisions en cinq étapes pour qualifier un logiciel en tant que dispositif médical. Ce processus repose sur des critères d'interprétation essentiels à connaître pour les fabricants de logiciels, chaque qualification étant évaluée au cas par cas.
Pour qu'un logiciel soit qualifié de dispositif médical, il doit remplir les critères suivants :
Figure 1 : Mon logiciel est-il un dispositif médical ?
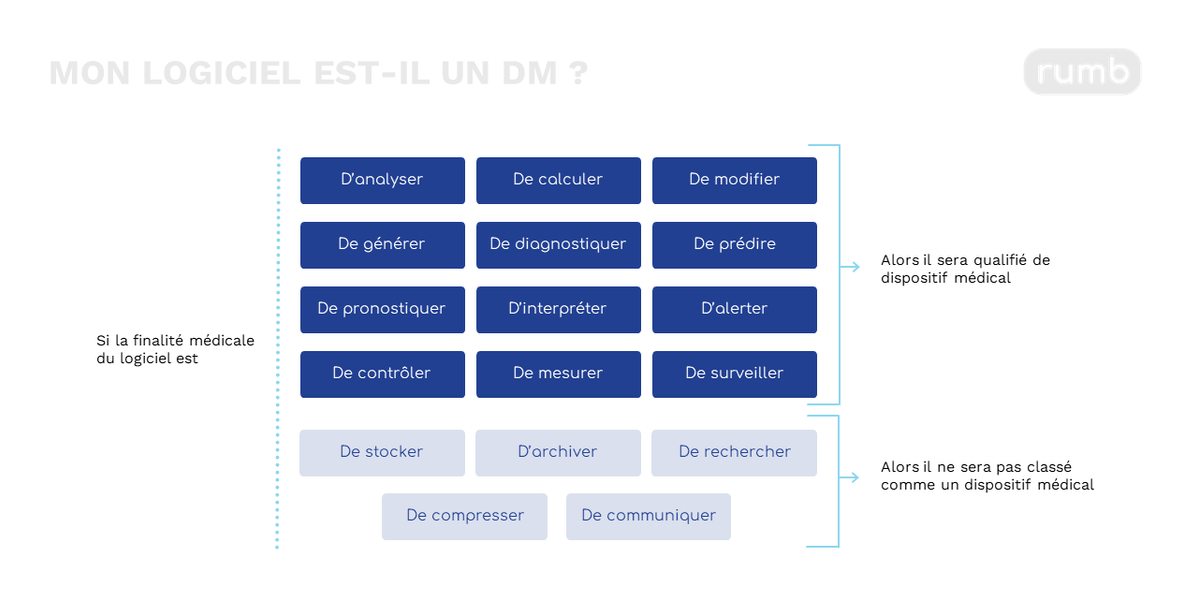
Quelle classe ?
La classification des DM logiciels est essentielle pour déterminer les exigences réglementaires spécifiques auxquelles les fabricants doivent se conformer pour obtenir l'autorisation de mise sur le marché de leurs produits.
Les DM logiciels sont classés en fonction du niveau de risque qu'ils présentent pour les patients et les utilisateurs. Cette classification est basée sur des critères tels que l'intention d'utilisation, la durée d'utilisation, le mode d'action du logiciel et le potentiel d'impact sur la santé publique.
Par exemple, les logiciels d’aide à la décision à des fins thérapeutiques ou diagnostiques relèvent de la classe IIa, sauf si ces décisions ont une incidence susceptible de causer :
Cependant, il est très complexe de déterminer la classe de son DM logiciel, car de nombreux autres paramètres entrent en jeu. Nous vous conseillons de vous entourer d’experts, qui sauront vous conseiller et vous orienter dans votre démarche.
Pour pouvoir commercialiser leur produit, les fabricants de DM logiciels sont soumis à la création d’un système de management de la qualité, défini par la norme ISO 13485, dans le cadre de leur parcours vers le marquage CE.
Quelles exigences spécifiques pour les DM logiciels ?
Les essentiels de la norme IEC 62304
Les normes IEC 62304 et IEC 82304 sont des normes internationales qui spécifient les exigences relatives au cycle de vie d’un DM logiciel. En lien avec l'obtention du marquage CE, la norme IEC 62304 est fréquemment adoptée comme cadre de référence pour attester la conformité des logiciels médicaux aux exigences réglementaires. Les fabricants de DM logiciels doivent respecter les principes énoncés dans cette norme tout au long du cycle de développement, depuis la conception initiale jusqu'à la maintenance continue du logiciel. La documentation conforme à cette norme revêt une importance cruciale lors des évaluations effectuées par les autorités de régulation.
Découvrez comment préparer sereinement
la mise en conformité de votre DM logiciel !
Pour appliquer la norme IEC 62304, il faut se conformer aux exigences générales suivantes :
• Mise en place d’un système de management de la qualité (ISO 13485)
• Application d’un processus de gestion des risques (ISO 14971)
• Attribution à une classe de sécurité du logiciel
Ainsi, la norme IEC 62304 définit 3 classes de sécurité du logiciel allant de A (la moins critique) à C (la plus critique). Elles se réfèrent à la gravité des conséquences d’une défaillance du logiciel. À mesure que le niveau de criticité augmente, le cycle de vie du DM logiciel à mettre en œuvre devra être complet, comprenant de nombreuses procédures.
Figure 2 : Les 3 classes de sécurité du dispositif médical logiciel
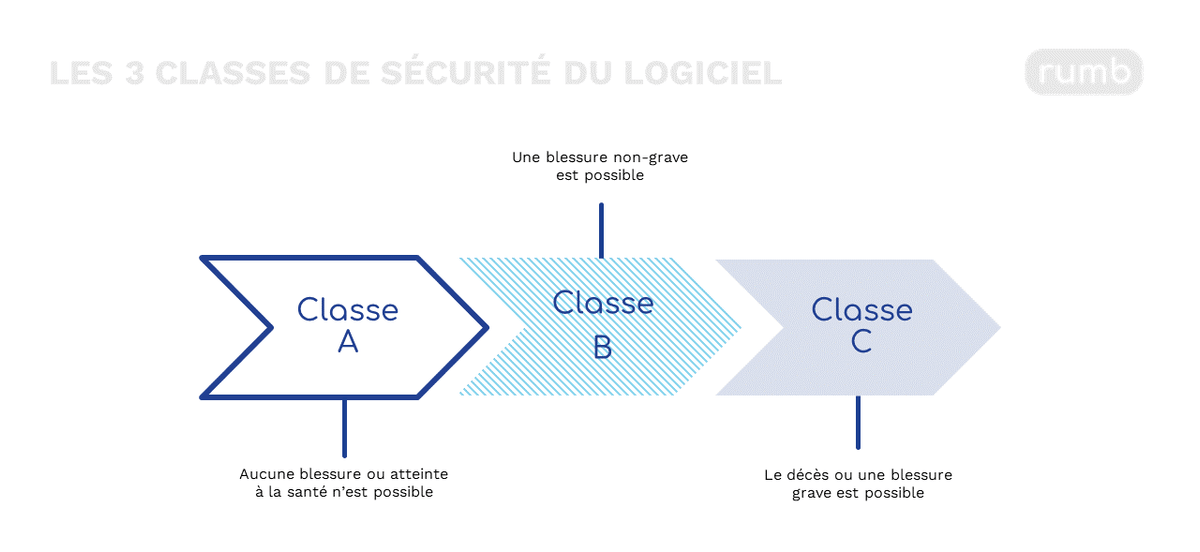
D’après la réglementation sur les dispositifs médicaux, plus les anomalies potentielles sont importantes, plus les exigences seront strictes quant à la conception et au développement des DM logiciels.
L'objectif de la classification de sécurité est d'ajuster le niveau de contrôle du cycle de vie du logiciel en fonction du risque encouru par le patient en cas de défaillance ou d'anomalie du logiciel. Cette classification influence donc l'effort nécessaire pour assurer la traçabilité et la gestion de la documentation technique, afin de démontrer la maîtrise des risques par la conception du dispositif médical.
Figure 3 : Influence de la classification sur les exigences de la documentation technique
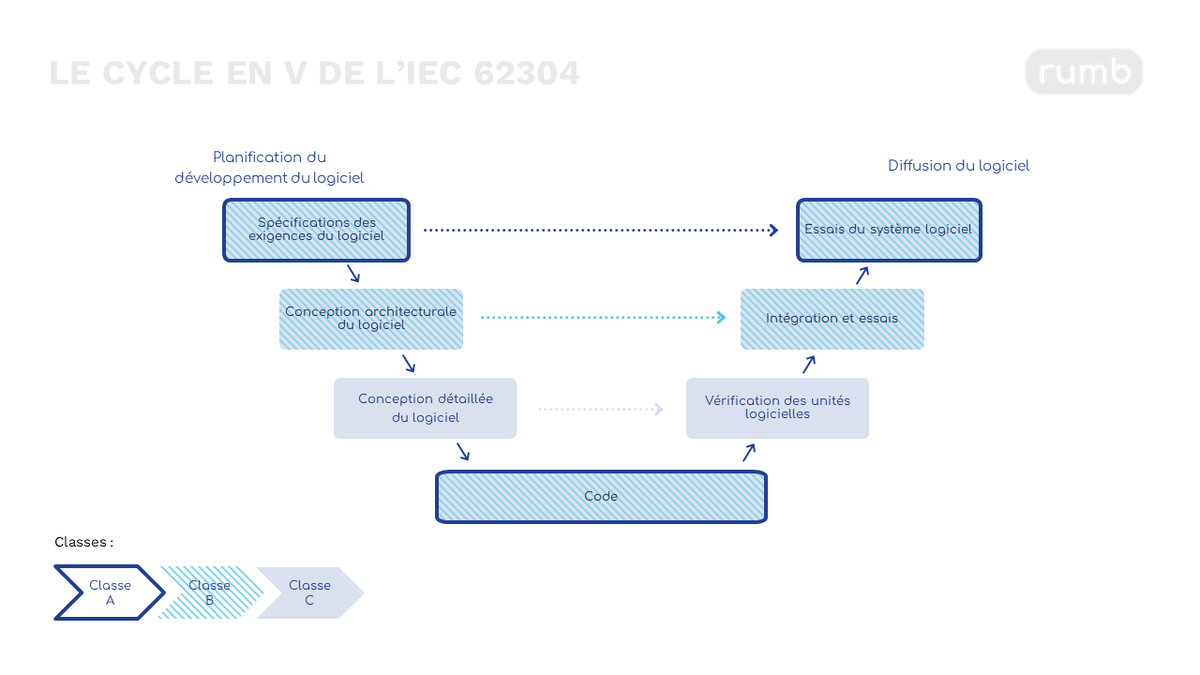
La norme IEC 82304
L’IEC 62304 est directement liée à l’IEC 82304. Pour cause, la norme IEC 82304 fournit les lignes directrices spécifiques pour évaluer et gérer les risques liés à la sécurité des logiciels et des systèmes de santé. Elle met l'accent sur l'identification et la gestion des risques associés à la sécurité des patients, des utilisateurs et des données médicales.
Elle définit des éléments supplémentaires pour :
Le principal ajout de l’IEC 82304 par rapport à l’IEC 62304 est celle de l’interface utilisateur, et des tests liés à l’utilisation d’une telle interface. Un plan de validation du logiciel et un rapport d’évaluation de ces tests est donc nécessaire pour étendre la philosophie de l’IEC 62304.
Ensemble, ces normes aident les fabricants de DM logiciels à concevoir, développer et maintenir des produits sûrs et efficaces, conformes aux réglementations en vigueur et répondant aux besoins cliniques des utilisateurs et des patients.
Pourquoi est-il difficile de réglementer les DM logiciels?
Le chemin vers la règlementation de son DM logiciel peut être long en raison de la nature complexe et évolutive de ces produits :
Rapidité de l'innovation : les progrès rapides dans le domaine de la technologie médicale conduisent au développement de nouvelles technologies et DM logiciels. Pour s’assurer que ces innovations sont utiles et sécurisées pour les futurs usagers, les régulateurs doivent mettre à jour et légiférer en continu sur les exigences qui s’y appliquent.
Évolution des risques : les risques associés aux DM logiciels peuvent évoluer avec le temps en raison de mises à jour logicielles, de l'intégration avec d'autres systèmes ou de l'utilisation dans des environnements cliniques variés. Les fabricants de DM logiciels doivent alors être capables d’anticiper et de répondre à ces risques évolutifs de manière proactive.
Interactions avec d'autres dispositifs : les DM logiciels peuvent interagir avec d'autres dispositifs médicaux, systèmes d'information clinique ou logiciels tiers, ce qui complique davantage la réglementation de ces produits et nécessite une coordination entre différents organismes de réglementation et parties prenantes.
Complexité du développement logiciel : le processus de développement des logiciels médicaux est souvent complexe, impliquant de multiples itérations de conception, de tests et de validations. Les fabricants doivent alors comprendre cette complexité pour assurer à la fois la sécurité et l'efficacité de leur DM logiciel.
Conclusion
Avec l'avènement du numérique, les dispositifs médicaux ont progressé pour offrir d'importants avantages aux patients, et l’intégration du numérique dans ces dispositifs a ouvert de nouvelles perspectives en termes d'engagement des patients, de personnalisation des soins de santé et d'amélioration de la qualité des services médicaux. Le processus de développement de ces logiciels médicaux est souvent complexe, et nombreux sont les fabricants de DM logiciel qui décident d’externaliser ce processus.
Comment trouver un partenaire fiable pour le développement de votre DM logiciel ?
Cet article est diffusé à titre informatif et ne constitue pas une référence normative ou règlementaire.